Výzkumný tým Pavla Plevky z institutu CEITEC Masarykovy univerzity popsal strukturu a replikační cyklus bakteriofága, který si dokáže bez problémů poradit s bakterií, proti níž přestávají působit existující antibiotika.
Je to obrovská naděje pro lidi s oslabenou imunitou nebo chronickým onemocněním, jimž hrozí vážné infekce. Bakteriofágy jsou viry, které se množí v bakteriálních buňkách.
Když se z bakterie uvolní fágové potomstvo, bakteriální buňka praskne a zahyne. Díky tomuto účinku se fágy začínají těšit větší pozornosti jako potenciální léčiva na patogenní bakterie rezistentní na antibiotika.
Unikát JBD30
Výzkumný tým Pavla Plevky z CEITEC Masarykovy univerzity nyní popsal strukturu a replikační cyklus bakteriofága JBD30, který infikuje a ničí bakterii Pseudomonas aeruginosa.
Ta u lidí způsobuje život ohrožující infekce dýchacích a močových cest a u lidí s oslabenou imunitou nebo u chronicky nemocných například cystickou fibrózou vyvolává závažné infekce.
Přestože fágy jsou nejpočetnější skupina organismů na naší planetě, mnohé aspekty jejich životního cyklu nám zůstávají utajeny.
Avšak v tomto případě strukturní virologové pomocí kryo-elektronové a super-rezoluční fluorescenční mikroskopie sestavili podrobný obraz toho, jak setkání fága JBD30 a bakterie P. aeruginosa probíhá.

Boj v mikrosvětě
Částice fága JBD30 je tvořena hlavičkou a bičíkem, který má tvar dlouhé trubičky. Jako většina virů je fág JBD30 velmi malý, délka jeho částice je 0,0002 milimetru, což je přibližně 10krát méně než průměr vlákna pavučiny.
Konec bičíku JBD30 je vybaven háčky, které fágu umožňují přichytit se na bakteriální pili. Pili jsou tenká vlákna, která bakterie opakovaně vysunují a zatahují a slouží jako jakési vrhací kotvy, pomocí nichž se bakterie posunují po povrchu.
„Bakterie se pomocí pilů pohybují, zkoumají své okolí a tvoří biofilm. Střídavé zatahování pilů je pro pohyb bakterií zásadní, čehož fág JBD30 chytře využívá.
Pomocí háčků na konci bičíku se fág přichytí na pilus a počká, až si ho bakterie k sobě sama přitáhne,“ říká hlavní autorka výzkumné práce Lucie Valentová.

Specificita interakce mezi háčkem na bičíku fága a pilem navíc orientuje částici fága JBD30 tak, že navázání fága na buňku připomíná přistání kosmického modulu na povrchu Měsíce.
„Po dosednutí na povrch se trojnožka fágových receptor vazebných proteinů otevře a vypustí z konce bičíku proteiny, které vytvoří kanál napříč buněčnou stěnou bakterie. Tímto kanálem pak fág vpraví svůj genetický materiál dovnitř buňky,“ doplňuje Pavel Plevka.
„Fágová DNA následně převezme kontrolu nad bakteriální buňkou a využije ji pro vlastní kopírování a k tvorbě nových fágových částic,“ uzavírá Lucie Valentová.

Výbuch podobný ohňostroji
Výsledky výzkumu, který vyšel ve vědeckém časopise EMBO Journal, také odhalily, co se děje v infikované bakteriální buňce. „Podařilo se nám vyfotit, jak se uvnitř buněk sestavují nové fágové částice.
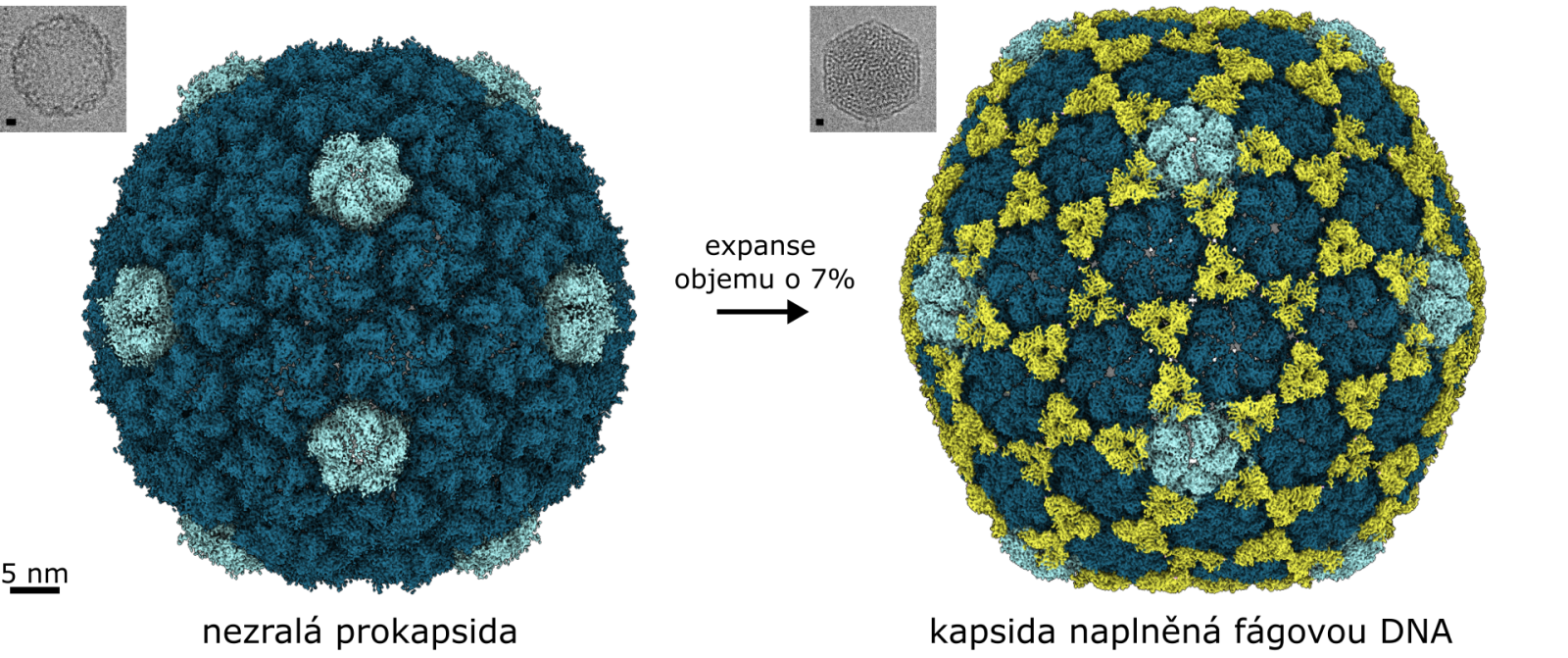
Hlavičky fága se nejdříve seskládají v nezralé formě a pak se naplní DNA nesoucí fágovou genetickou informaci. K naplněným hlavičkám se posléze připojí bičíky, které se sestavily nezávisle,“ vysvětluje Pavel Plevka.
V závěru infekčního cyklu fág produkuje enzymy, které zevnitř narušují buněčnou stěnu bakteriální buňky, až dojde k jejímu výbuchu. „Pod mikroskopem vypadá rozpad bakterií trochu jako ohňostroj.
Buňky praskají a do svého okolí uvolňují nové fágy,“ zakončuje Lucie Valentová. Způsob, jakým fág JDB30 infikuje a zabíjí bakterie je odlišný od mechanismů působení antibiotik, které blokují specifické životně důležité funkce bakteriálních buněk.