Až na samém konci minulého tisíciletí se dostalo uznání v podobě Nobelovy ceny dlouho vysmívané teorii, že mozek může zničit nákaza přenášená nikoli mikroby, ale pouhými bílkovinami.
Ovšem ani o čtvrt století později stále nevíme, jak přesně mozkové buňky zabíjejí, a už vůbec jim v tom nedokážeme zabránit.
Stanley Prusiner musel být velmi tvrdohlavý muž, když dal v sázku svou vědeckou pověst jen proto, že věřil tomu, co viděl. Jeho hypotéza zněla jako čiré kacířství. Přitom zdánlivě nešlo o nic zvláštního.
Bylo to na přelomu 70. a 80. let minulého století, když se Prusiner, neurolog na Kalifornské univerzitě v San Franciscu, zabýval zkoumáním klusavky, podivné nemoci, která postihovala ovce a měnila jejich mozek na ementál plný děr.
Nešlo o žádnou novinku, nemoc byla známá po staletí. Přesto se pořád nevědělo, co ji vlastně vyvolává. Dosavadní experimenty jen prokázaly, že klusavka je nakažlivá a že ji přenosem tkáně z nemocných ovcí lze vyvolat i u zdravých kusů a pak i u jiných zvířat.
Počátkem 70. let se jistému americkému týmu dokonce povedlo klusavkou experimentálně nakazit makaky. Jenže záhadný virus, který se za infekcí musel skrývat, stále unikal.
Stanley Prusiner se do jeho hledání zapojil spíš náhodou, když mu zemřel pacient, který trpěl velmi vzácnou Creutzfeldt-Jakobovou chorobou. Ta je neléčitelná a nápadně podobná klusavce.
To vzbudilo Prusinerovu zvědavost a touhu přijít příčině těchto nemocí na kloub. Jenže experimenty vycházely podivně. Výsledky stále více ukazovaly na proteiny a stále méně na stopy virů.
Těmi měly být nukleové kyseliny, DNA nebo RNA, jenže ve vzorcích jaksi chyběly. To není možné, řekl Prusiner sám sobě i svému týmu. Nemůžou to být proteiny – každý středoškolák přece ví, že se nemůžou „množit“.

Nové experimenty
A tak začali znovu. Vzorky mozků nemocných ovcí důkladně pročistili, až podle Prusinerových zápisků odstranili 99 % cizorodých proteinů a nukleových kyselin, které se do nich dostaly jako kontaminace. V tom, co zbylo, začali cíleně pátrat.
Jenže hledaný patogen byl dál nepolapitelný. A tak se na to rozhodli jít vylučovací metodou. Na část vzorků použili postupně šest různých metod, které rozbíjely nukleové kyseliny, v dalších zase šesti metodami štěpili proteiny.
Pak zbýval rozhodující krok – vyzkoušet, který postup zabral víc. Překvapení se nekonalo. Výsledek opět ukázal na proteiny stejně jako v předchozích experimentech. Přenos nemoci dokázal omezit jen zásah proti nim.
Pochyby i uznání
Prusiner byl přesvědčený, že má dostatek důkazů pro hypotézu, že jsou to proteiny, co způsobuje degenerativní onemocnění mozku u ovcí. Nevěděl sice, jak to dělají, zato prokázal, že se upravené vzorky tkání se zachovanými proteiny chovají jako infekce.
Původcům nákazy dal také název – priony. Vyšel ze spojení anglických slov pro protein a infekci, ale pro větší zvukomalebnost písmenka trochu přehodil, protože „proiny“ nezněly zdaleka tak dobře.
Svůj výzkum publikoval v 1982 v prestižním časopise Science pod titulkem Nové proteinové infekční částice způsobují klusavku a na odpor a výsměch byl připravený.
A skutečně následující desetiletí strávil obhajováním své prionové hypotézy před pochybnostmi i útoky řady vědců.
Důkazů, podporující jeho hypotézu oproti táboru trvajícím na dosud neobjeveném viru, ale přibývalo, a tak Prusiner dostal v roce 1997 Nobelovu cenu.
Nebyla první v souvislosti s degenerativním onemocněním mozku záhadného původu, které se projevovalo tak, že v něm vznikaly dutiny. Naprosto stejné projevy měla záhadná nemoc kuru.
Americký vědec Carleton Gajdusek ji zkoumal na Papui-Nové Guineji, kde se stále udržoval zvyk pojídat mrtvé včetně těch nakažených. Ani Gajdusek si ale nebyl jistý, co je vlastně původcem nemoci. Prionům ale nevěřil, infekci připisoval pomalu se šířícím virům.

Nemoc šílených krav
Nobelovka pro Prusina přišla v době, kdy se světem šířila panika z „nemoci šílených krav“. Ta byla podobná jak klusavce, tak kuru z Papuy-Nové Guiney. Objevena byla v polovině 80. let v Británii a dostala odborný název bovinní spongiformní encefalopatie.
Výzkum sice nenašel původce nemoci, zato její zdroj. Všechny nakažené krávy dostávaly do krmiva masokostní moučku vyrobenou z ovcí včetně těch, které uhynuly na klusavku.
Při její výrobě se široce obcházela nastavená pravidla sterilizace horkem a tlakem v zájmu snížení nákladů.
A tak není divu, že patogeny klusavky z infikovaných ovcí úpravu přestály bez úhony a při krmení pak infikovaly dobytek. Ovšem ani dodržování hygienických norem by priony nezničilo – na rozdíl od mikrobů.
Experimenty ukázaly, že odolávají i mnohem vyšším teplotám, některé priony se udržely i v mase, které bylo po celou hodinu vystaveno teplotě 360 °C. Nerozložené byly objeveny i po třech letech na místě zetlelých těl krav.

Přenos na člověka
Infekce nejdřív zůstávala problémem chovatelů dobytka, dokud se neukázalo, že je přenosná na člověka, u nějž vyvolává už dříve známou, ale velmi vzácnou Creutzfeldt-Jakobovu chorobu. Jenže najednou se v Británii objevilo hned deset případů současně.
Nemoc budila hrůzu, protože degenerace mozku, kterou způsobovala, postupovala rychle a neúprosně a bez výjimky skončila smrtí.
I tak trvalo deset let od prvních varování od odborníků, než britská vláda v roce 1996 připustila, že by mohla existovat souvislost mezi nemocí šílených krav a novou variantou Creutzfeldt-Jakobovy choroby.
A celou tu dobu se dál mohly prodávat kontaminované hamburgery, uzeniny, ze želatiny z kůže a kostí se dělal pudink, polevy dortů a gumoví medvídci. Přitom už vědci prokázali, že při konzumaci priony dokážou proniknout ze žaludku do nervové tkáně.
Než se konečně zpřísnila hygienická pravidla pro chov skotu a zpracování masa, vyžádala si Creutzfeldt-Jakobova choroba asi 250 lidských životů, v naprosté většině v Británii. Poté nových nákaz razantně ubylo, další se objevovaly jen raritně.
Co se to v mozku děje?
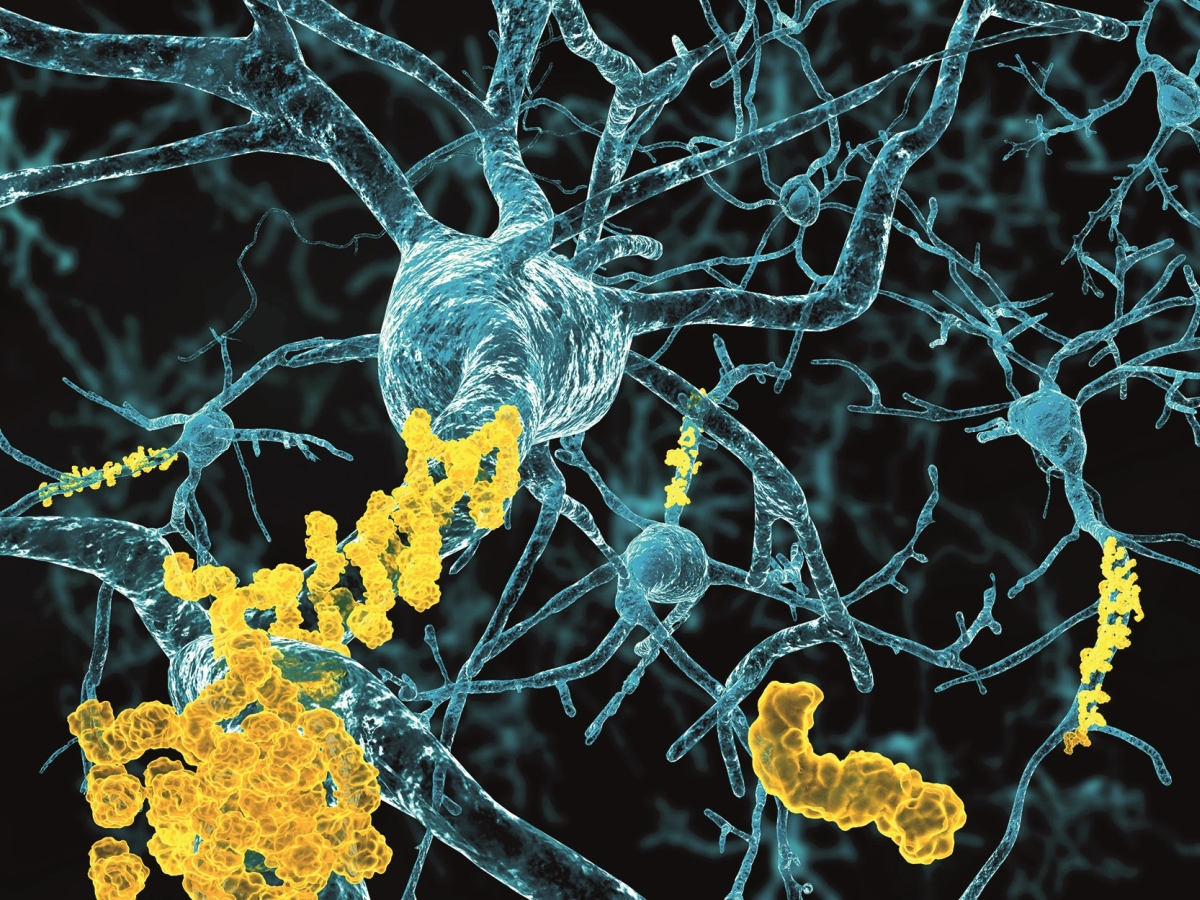
Příčina nemoci je nesmírně záludná. Priony nejsou nic cizorodého. V původní a neškodné formě je produkuje většina buněk našeho těla. Problém nastane až v případě, že původní neškodný prionový protein získá nesprávný prostorový tvar. To změní jeho vlastnosti a chování.
Změněný tvar navíc působí jako kouzelná hůlka – když se zvrhlý protein dotkne dosud zdravého proteinu, i ten stejným způsobem změní své uspořádání a změní se na nebezpečný prion. To samé pak udělá se sousedním proteinem a záhy se změny dominovým efektem šíří jako lavina.
Tím problém nekončí. Nově vzniklé priony se shlukují, vytvářejí vlákna a začínají ničit mozkové buňky, jež jsou vůči nim bezmocné. Změněný protein získává kromě ničivosti také nebývalou odolnost. Buněčné enzymy by ho vlastně měly rozložit, jenže to se neděje.
A tak mozkové buňky zanikají a na jejich místě vzniká dutina. Priony se šíří mozkem exponenciálně a zaplavují ho ještě dřív, než se objeví neurologické příznaky.

Zdroj ve vlastní hlavě
Přenos infekčních proteinů ze zvířete je sice zdaleka nejčastější příčinou onemocnění, ale nikoliv jedinou. Někdy mohou vzniknout přímo v lidském mozku.
Většinou k tomu dochází náhodně, když normální prionový protein změní samovolně svůj tvar a pak spustí rychle eskalující řetězovou reakci. Chyba může být také v genu, který nese předpis pro stavbu prionového proteinu.
Mutace ale naštěstí nemusí mít vždy fatální následky. Výzkum už odhalil šest desítek různých variant genu pro prionový protein, ale jen zlomek z nich má vést k propuknutí nemoci. Tato rozmanitost prionů je komplikací při vývoji léků.
I když účinné látky zničí jednu z těchto špatně poskládaných konfigurací, jiné přetrvávají a mohou vyvolat rezistenci vůči léku.
Proč je vůbec máme?
Taková otázka se pochopitelně nabízí. Je prionový protein pro organismus tak důležitý, že ho tvoří nehledě na to, že může jít o časovanou bombu? Uspokojivé odpovědi zatím nemáme. Výsledky výzkumů jsou spíš nepřehledné.
Na jednu stranu se ukázalo, že zvířata s odstraněným genem mohou žít bez zjevných potíží a poškození, na druhou stranu se vrší důkazy o rozmanitých funkcích prionového proteinu v těle.
Důležitý je zřejmě hlavně pro správnou krvetvorbu a možná paradoxně i pro vývoj a ochranu neuronů. Nicméně se zdá, že ho bez větších následků můžeme postrádat, takže zablokování jeho tvorby se zatím jeví jako nejslibnější možnost léčby. Mnoho jiných se ostatně nerýsuje.
Závod s časem
Proto se výzkum zaměřuje na snížení produkce zdravého prionového proteinu v mozku. Čím méně ho bude, tím pomaleji by nemoc postupovala.
Experiment u myší, které vytvářely jen polovinu normálního množství prionového proteinu, ukázal, že rozvinutí onemocnění trvalo více než dvakrát déle.
Momentálně se k tomu účelu zkoušejí drobné, chemicky upravené sekvence DNA, které se vážou na RNA s návodem pro stavbu prionového proteinu. Buňka pak celý komplex zničí a protein nevznikne.
Pokud by byla metoda úspěšná nejen u myší, ale také u lidí, mohla by otevřít také novou šanci pro terapii dalších neurodegenerativních onemocnění, jak se domnívá Prusiner i někteří další odborníci.
Poukazují na to, že také u Alzheimerovy nemoci, Parkinsonovy choroby a Huntingtonovy choroby hrají roli různé proteiny, jejichž chování velmi připomíná priony.